軸突損傷通常會導致神經元死亡,除非鼓勵神經元避開雙亮氨酸拉鍊激酶(DLK)信號通路。研究人員了解到,當該途徑被阻斷時,神經元在軸突損傷性神經退行性疾病模型中更容易存活。但是可惜,神經元不會蓬勃發展。也就是說,它們不會再生軸突。問題是,關閉DLK通路不僅可以防止細胞死亡。它還抑制軸突再生。
根據加州大學聖地亞哥分校的科學家的說法,神經元可能會受益於替代途徑的關閉,特別是受生髮細胞激酶四族(GCK-IV)激酶調控的信號通路。科學家報告說,阻斷GCK-IV激酶可能有助於神經元生存和成長,即使它們正與軸突損傷性神經退行性疾病作鬥爭。這些疾病範圍從青光眼到阿爾茨海默氏病。
科學家,德里克·S. Welsbie,醫學博士,在眼科維特比家庭部眼科副教授希利眼科研究所在加州大學聖地亞哥分校健康,導致了他們的工作,12月14日在國家科學學院院刊( PNAS )在題為“抑制GCK-IV激酶使中樞神經系統神經元的細胞死亡和軸突再生解離的過程中”。
文章的作者指出:“ [目前尚無提供長期的神經保護和損傷後軸突再生的策略。” “ [我們]將GCK-IV激酶家族確定為可最大化神經保護並促進軸突再生的靶標,使其成為治療一部分神經退行性疾病的有吸引力的治療方法。”
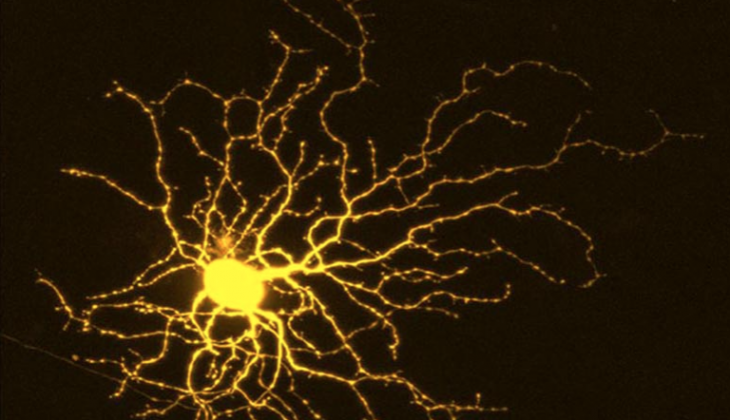
科學家在人類幹細胞來源的視網膜神經節細胞(hRGCs)中使用蛋白激酶抑製劑庫進行了一系列互補的高通量篩選。 RGC是位於眼睛視網膜內表面附近的神經元。他們從感光器接收視覺信息,並共同幫助將該信息傳遞到大腦。
第一個篩選包括測試一組經過精心研究的化學藥品,以評估其增加RGC存活率的能力。第二個衡量化學物質促進再生的能力。在進行了這些篩選之後,科學家們確定了“能夠促進神經保護和神經突生長的重疊化合物在生物信息學上被解卷積,以鑑定調節神經元死亡和軸突再生的特定激酶。”
“ [本質上,我們]使用機器學習技術來理解為什麼某些化合物具有活性而其他化合物則不具有活性,並且可以識別這些關鍵基因,”韋爾斯比說。他補充說,這些基因改善了RGC存活率的發現不足為奇。 “但是,您可能已經預測到,它們(如DLK)在被抑制時會阻止再生,而不會促進再生。這絕對是一個驚喜。
“ [我們的發現]突出顯示了使用高通量篩選的基於發現的科學的優勢之一:通過一次測試許多代理,我們可以發現被忽略的基因,這些基因可能沒有被認為發揮作用。”
Welsbie和同事將他們的工作重點放在了RGC上,因為他們對視神經病變(例如青光眼)感興趣。 “大多數人只在’眼壓’方面考慮青光眼,”韋爾斯比說。但是眼壓只是問題的一部分。青光眼的核心是神經退行性疾病,其特徵是RGC及其軸突的逐漸喪失,導致可測量的視神經結構和功能受損,視力障礙和失明。
“使用腺相關病毒(AAV)方法,再結合基於[CRISPR]的基因組編輯,我們驗證了GCK-IV激酶敲除可以改善神經元存活,與DLK敲除相當,同時還可以促進軸突再生。”詳細介紹了PNAS。 “最後,我們還發現,在不損害軸突生長的情況下,GCK-IV激酶抑製作用還可以阻止視網膜類器官培養物中RGC的磨損,這是乾細胞衍生視網膜領域的一個主要問題。”
韋爾斯比警告說,目前還不清楚這些發現是否超出了RGC的範圍,還擴展到了其他神經元類型,但他指出這項工作表明了強大的治療可能性。
他解釋說:“我們基本上發現,有一組基因在被抑制後可使視神經細胞存活並再生。” “在這項工作之前,該領域知道如何使這些細胞存活,但不能再生。相反,有多種促進再生的方法,但是存活率相當低。當然,對於成功的視力恢復策略,您同時需要這兩者,這是朝這個方向邁出的一步。”
PNAS文章的作者總結道:“ [我們的結果]證明了GCK-IV激酶在解離神經元的細胞死亡和軸突生長中的作用,其可藥物性為神經退行性疾病提供了治療選擇。”
AAV / CRISPR系統的模塊性質應允許在[GCK-IV激酶抑制的生存益處]的背景下評估[再生擾動]的不同排列。此外,GCK-IV激酶是可藥物治療的靶標,它為與其他前體再生策略的組合療法提供了新的可能性,以最大限度地提高生存率和軸突再生的潛力,從而恢復功能。 ”